Détermination des Durées de Vie Microbiologiques : quelles nouveautés sur les DLC / DDM ?

La DGAL a publié récemment une nouvelle Instruction Technique sur la validation des durées de vie microbiologiques. Depuis le 29/04/2024, l’IT DGAL/SDSSA/2024-270 a remplacé l’IT DGAL/SDSSA/2019-861.
Objectif et champ d’application
L’IT 2024-270 d’avril 2024 conserve les objectifs de base mais elle insiste davantage sur les différences entre validation et vérification de la DVM. Elle intègre un nouveau logigramme issu d’un document de l’EFSA destiné à faire le distinguo entre nécessité d’une DLC ou d’une DDM. Elle maintient la possibilité de mutualisation des études mais dans un contexte toujours aussi restreint qui rend la mutualisation compliquée dans les faits.
Dans la nouvelle IT, on rappelle que c’est bien au professionnel de déterminer si la date à apposer est une DLC ou une DDM.
Cependant, un nouveau paragraphe sur la Date de durabilité minimale (DDM), explique que dans certains contextes, une DDM peut remplacer une DLC sur des denrées d’origine animale stables à condition qu’elle soit gérée et validée comme une DLC en prenant en compte une marge de sécurité. Tel que formulé, le nouveau paragraphe pourrait être mal interprété et créer une confusion supplémentaire entre les notions de DLC et DDM.
Méthodologie de validation et de vérification
La méthodologie d’établissement des DVM ne change pas mais l’IT de 2024 détaille davantage les procédures de validation ; elle insiste sur la différence entre validation et vérification qui sont traitées dans des chapitres séparés.
Pour mémoire, on notera qu’il faut passer par des étapes incontournables :
- Description du produit et du procédé en prenant en compte les paramètres les plus défavorables
- Caractérisation des moyens de maitrise et de surveillance de la variabilité inter et intra-lots
- Classement des produits en catégories homogènes
- Choix des microorganismes pris en compte
- Validation initiale de la DVM avec études de vieillissement et éventuellement études complémentaires
- Vérification de la DVM au cours du temps et constitution d’un historique d’autocontrôles exploitables
En ce qui concerne l’identification et la description du produit, la nouveauté concerne les produits d’assemblage : les caractéristiques physico-chimiques de chaque composant doivent être mesurés. Outre la définition d’un produit d’assemblage qui n’apparaît pas, cette exigence ne sera pas sans poser de nombreux problèmes techniques, surtout pour les salades ou les plats cuisinés.
La nouvelle IT cite à plusieurs reprises un document d’orientation technique du Laboratoire de référence de l’UE pour Listeria monocytogenes (EURL Lm) sur les challenge-tests et la détermination des durées de vie dans sa version 3 ou 4 en différents endroits du texte.
Il est impossible de savoir s’il faut se référer à la version 3 ou la version 4 de ce guide EURL Lm. Cela n’est pas un détail dans la mesure où ces 2 versions comportent des différences importantes sur les températures de stockage par exemple : 8 et 12°C en v3 et 7 et 10°C en v4.
Cas particulier de Listeria monocytogenes
Dans la nouvelle instruction, le cas particulier de Listeria monocytogenes est plus détaillé. En particulier pour expliquer les éléments nécessaires à la constitution du dossier de validation de la DVM mais aussi pour rappeler la nécessité d’études complémentaires afin de justifier du non-dépassement du critère <100 ufc/g pendant toute la durée de conservation si besoin. Cette condition étant nécessaire pour utiliser ce critère sur les matrices où le développement ou la survie de Listeria monocytogenes sont considérés comme possible.
Dans le document, on écrit « qu’un test de vieillissement sera d’autant plus pertinent qu’il aura été réalisé sur un lot identifié comme contaminé en Listeria monocytogenes à J0 ». Cette position technique n’est pas vraiment consensuelle. Elle pose de nombreux problèmes pratiques dans la mesure où :
- Lorsqu’on lance un test de vieillissement, on ne peut pas savoir a priori si le produit est contaminé en Listeria monocytogenes.
- Grace aux BPH et aux BPF, la prévalence de Listeria spp peut être tellement faible que cette situation sera heureusement très rare, il sera alors compliqué de réaliser un véritable historique sur un événement aussi peu fréquent.
- Il est précisé que dans l’attente de la constitution du dossier, c’est le critère ND dans 25g qui sera appliqué.
L’historique des tests de vieillissement étant nécessaire à la constitution du dossier, son montage sera compliqué à moins d’avoir des produits régulièrement contaminés en Listeria monocytogenes, ce qui n’est pas la règle pour de nombreux produits quand les BPH et les BPF sont correctement appliquées.
On peut penser que c’est une façon de restreindre le critère <100 Lm/g puisqu’il ne pourra pas s’appliquer sans dossier validé par l’autorité compétente.
Quand faut-il refaire la validation ?
Il n’y a pas d’évolution sur ce point, l’IT 2024-270 rappelle les conditions qui nécessitent une nouvelle validation :
- tout changement significatif dans la composition de produits existants
- modifications de l’atelier de fabrication et/ou des équipements de production.
- développement de produits nouveaux ou modification de produits existants,
- développement de nouveaux procédés de fabrication ou modification de procédés existants,
- développement de nouveaux types de conditionnement ou modification de conditionnements
Annexes et documentation
L’IT 2024-270 comprend une nouvelle annexe issue d’un document de l’EFSA. C’est un logigramme destiné à faciliter le choix des opérateurs entre la nécessité d’une DLC ou d’une DDM. Ce choix est conditionné par les caractéristiques physico-chimiques de la matrice en lien avec les possibilités de croissance ou de toxinogenèse des différents pathogènes d’intérêt et le procédé.
La version intégrée dans l’IT 2024-270 pose la limite de croissance des pathogènes pour les matrices d’Aw> 0.96 à pH 1,9. Cela n’est pas correct. En effet, le vinaigre à 8% présente un pH de 2,3. Ce n’est pas un bon milieu de culture pour les pathogènes.
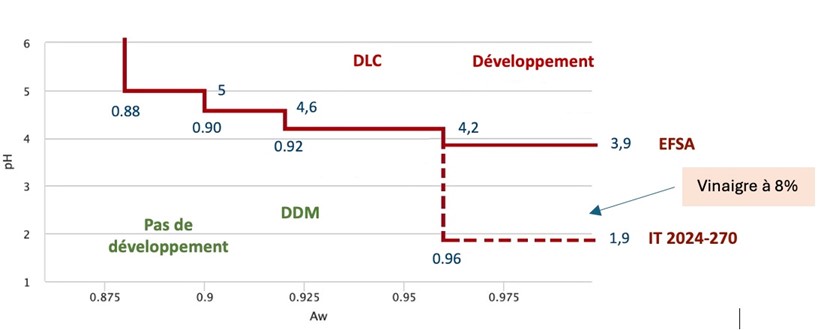
Dans le document original de l’EFSA, cette limite est fixée à pH 3,9 ce qui paraît plus conforme aux données bibliographiques sur les pathogènes. Ainsi, d’après le logigramme de l’IT 2024-270, il faudrait apposer une DLC sur le vinaigre.
Il est donc probable que l’annexe I soit inutilisable pour un grand nombre de produits alimentaires acides dont l’Aw dépasse 0.96.
Conclusion
L’instruction DGAL/SDSSA/2024-270 ne marque pas d’évolution significative par rapport à la version de 2019. Elle est malheureusement entachée d’erreurs de référençage ou de liens invalides qui ne facilitent ni sa lecture, ni son utilisation.
Un paragraphe ambiguë sur les DDM risque d’entrainer une confusion quant à l’interprétation des deux concepts bien différents de DLC et de DDM.
Une donnée erronée concernant la limite de développement des pathogènes concernant le pH (1,9 à la place de 3,9) rend inopérant pour partie un logigramme permettant de distinguer la nécessité d’étiqueter une DDM ou une DLC.
L’idée qu’un test de vieillissement n’est vraiment pertinent que s’il est réalisé sur un lot naturellement contaminé en Listeria monocytogenes perdure, bien que cela pose des problèmes concrets d’application pratique pour les produits dans lesquels la prévalence en Listeria monocytogenes est faible.
Même si elle n’est pas cohérente quant à la version à utiliser (v3 ou v4 ?), l’Instruction Technique 2024-270 cite de nombreuses fois un document de l’EURL Lm sur la validation des durées de vie et les challenges tests. Ce document a vocation à servir de référence européenne dans un contexte d’évolution du règlement (CE) n°2073/2005 pour la gestion du critère Listeria monocytogenes. Malheureusement, le document dans sa version actuelle n’est pas parfait et contient des erreurs et des éléments dévalidés par l’ANSES dans la pratique. Il aurait besoin d’une mise à jour et de corrections avant de pouvoir servir de véritable référence pour la France et pour l’UE.
En ce qui concerne la réalisation d’études complémentaires et en particulier la réalisation de challenge-tests concernant Listeria monocytogenes, l’IT 2024-270 rappelle qu’un réseau de laboratoires reconnus, supervisé par le Laboratoire National de Référence de l’ANSES a été mis en place par la DGAL. Ces laboratoires doivent répondre à un ensemble d’exigences techniques et de compétences requises décrites dans l’IT DGAL/SDPAL/2016-688. La liste des laboratoires reconnus est mise à jour régulièrement. Elle est accessible sur le site du ministère.
Les laboratoires de microbiologie de l’IFIP sur le site du CIRI à Romillé (35) font partie des laboratoires reconnus pour la réalisation des challenge tests pour Listeria monocytogenes.
– L’IFIP peut vous accompagner dans vos démarches de validation de durée de vie, en tant qu’ITAI, membre du RMT Qualima : Formations pour les responsables qualité (inter-entreprises et sur mesure), accompagnement à la constitution du dossier complet de validation, réalisation de tests de vieillissement, de tests de croissance procédés et produits.
– La DGAL reconnait l’IFIP pour valider les dossiers de durée de vie microbiologique des aliments et la réalisation des tests de croissance (potentiel de croissance et taux de croissance).

Contacts : etienne.pierron@ifip.asso.fr – 06 16 98 25 69/ carolina.lopezrizo@ifip.asso.fr – 06 59 53 60 44 /bastien.fremaux@ifip.asso.fr – 07 62 53 63 76








